暨医成果要报|林雪嘉、尹芝南和李振华教授等团队在国际顶尖学术期刊Molecular Cancer发表论文
发布时间:2025-09-03发布单位:医学部/党委医学工作部
近日,暨南大学林雪嘉、尹芝南和李振华研究团队在国际权威期刊Molecular Cancer(一区Top,IF=33.9)上发表题为“Single-cell transcriptome reveals the reprogramming of immune microenvironment during the transition from MASH to HCC”的研究论文(https://pmc.ncbi.nlm.nih.gov/articles/PMC12153197/)。该研究通过单细胞转录组技术全景解析MASH向HCC恶变过程中肝脏免疫微环境的重编程,并阐明载脂蛋白E(ApoE)这一关键分子重塑肿瘤免疫微环境的机制,为防治MASH相关肝癌提供潜在靶点!

非酒精性脂肪性肝病(NAFLD),现称为代谢功能障碍相关脂肪性肝病(MASLD),已成为慢性肝病的主要原因,影响全球四分之一的人口,其中约20%的病例会发展为更严重的代谢功能障碍相关脂肪性肝炎(MASH),并进一步进展为肝硬化乃至肝细胞肝癌(HCC)。目前MASH向HCC转变的具体机制尚不完全清楚,有待挖掘。
研究团队通过构建多个MASH向HCC转化的小鼠模型,并采用单细胞转录组技术、流式细胞术、多重免疫组化等多种实验手段解析MASH向HCC恶变过程中肝脏免疫微环境的动态变化,关键发现包括:
1. 免疫抑制与耗竭性T细胞的诱导
·在MASH向HCC的转变中,CD4⁺和CD8⁺ T细胞表现出耗竭表型(GZMK+LAG-3+PD-1+CD4+, GZMK+LAG-3+PD-1+CD8+)和免疫抑制特性(IKZF2⁺OX40⁺FOXP3⁺CD4+, LY49I+LY49G+IKZF2+FOXP3−CD8+, IKZF2+FOXP3+CD8+)。
·gd T细胞中IL-17A⁺亚群增加,促进炎症环境,而耗竭性gd T细胞(表达PD-1)在肿瘤中富集。
2. B细胞的免疫抑制分化:
· B细胞分化为免疫抑制性浆细胞(IgA⁺)和Gm31243⁺ B细胞,可能通过代谢通路(如NAFLD相关通路)促进肿瘤进展。
3. NK细胞功能衰减:
· 成熟NK细胞(mNK)减少,激活标志物(如LY49D/H)和杀伤分子(如GZMA)表达降低,导致抗肿瘤能力下降。
4. 髓系细胞的重编程:
· 肿瘤相关巨噬细胞(TAMs)和耐受性树突细胞(tDCs)增加,进一步抑制抗肿瘤免疫。
5. ApoE的关键作用:
· 多种免疫细胞(T细胞、B细胞、巨噬细胞等)在HCC中高表达载脂蛋白E(ApoE),其缺失通过抑制ApoE-PI3K-AKT-NF-kB和ApoE-PI3K-AKT-c-Jun/c-Fos通路,显著延缓MASH驱动的肝癌发生。
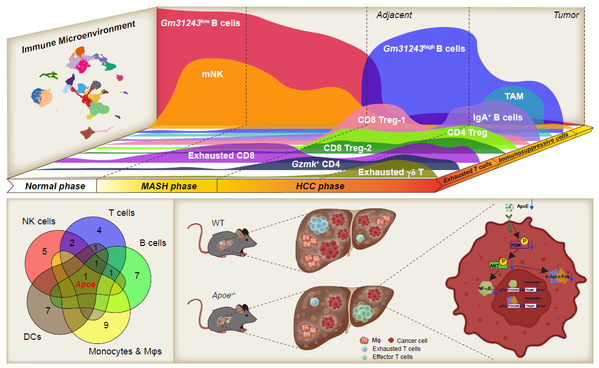
文章总结图
暨南大学林雪嘉副研究员、尹芝南教授、李振华副教授为论文的共同通讯作者;博士研究生黄煜和谢莹为论文的共同第一作者。该研究得到了国家自然科学基金、广东特支计划科技创新青年拔尖人才项目、广州市珠江科技新星项目、广东省基础与应用基础研究重大项目、国家重点研发计划项目和111项目的资助。
