暨医成果要报 | 罗良平教授团队在国际知名学术期刊Acta Pharmaceutica Sinica B发表原创学术论文
发布时间:2025-12-18发布单位:医学部/党委医学工作部
近日,暨南大学罗良平/肖泽宇教授团队在国际知名期刊Acta Pharmaceutica Sinica B(IF=14.6)发表题为“Engineered bacterial extracellular vesicles mediate pyroptosis to counteract m6A methylation-based immunosuppression after insufficient radiofrequency ablation of hepatocellular carcinoma”的原创论文。
射频消融(RFA)是肝细胞癌的重要治疗手段,但消融不足(IRFA)易诱发肿瘤复发。前期研究发现,过渡区肿瘤细胞在亚致死热应激下出现持续性表观遗传重编程:METTL3核转位并增强m6A催化活性,经m6A-YTHDF1-EGFR 轴促进肿瘤进展,同时残余病灶大量募集 MDSC和TAM,形成免疫抑制性微环境,提示有必要同时靶向m6A甲基化与免疫微环境失衡。

来源于革兰氏阴性菌的外膜囊泡(outer membrane vesicles, OMVs)作为一种新兴的生物载体,兼具药物递送与免疫调节优势,可通过与肿瘤细胞膜直接融合实现高效、精准的胞内递送并减少非特异性蓄积。本研究以大肠杆菌来源 OMVs为基础,引入m6A甲基化抑制剂STM2457和 Mn²⁺,构建新型工程化递药体系 STM-Mn@OMVs。该体系可诱导肿瘤细胞焦亡(pyroptosis),协同激活 STING通路,促进树突状细胞成熟和T细胞活化,增强抗肿瘤免疫应答,并显著降低 Tregs、MDSCs浸润,促使肿瘤相关巨噬细胞由免疫抑制向免疫激活表型转变,从而部分逆转免疫抑制性肿瘤微环境。
在皮下与原位肝细胞癌小鼠模型中,STM-Mn@OMVs 明显抑制肿瘤生长并延长小鼠生存期,显示出优良的抗肿瘤效能和生物安全性。研究团队通过系统材料表征及多维度体内外实验,结合MRI、流式细胞术、Western blot、ELISA等技术,综合评估了该体系的肿瘤靶向性、免疫激活能力与安全性。结果证实,STM-Mn@OMVs可抑制M6A甲基化修饰、激活STING信号并诱导焦亡,协同重塑免疫微环境,有效遏制IRFA后残余肿瘤进展,为提升肝细胞癌综合治疗效果提供了新策略,具有良好的临床转化前景。
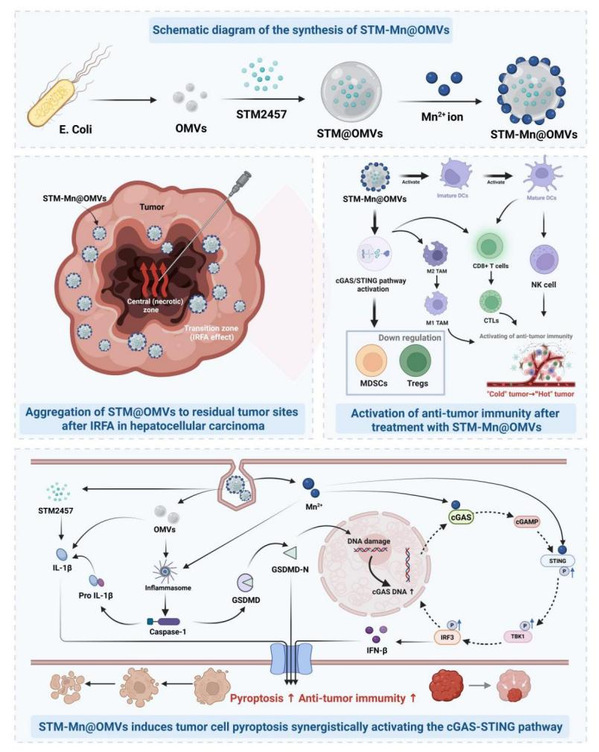
图1 负载Mn2+和STM2457的新型OMVs递药体系(STM-Mn@OMVs)示意图
[主要作者简介]

罗良平,德国洪堡大学医学博士,医学影像学二级教授,主任医师,博士生导师;暨南大学精准医学研究院院长,暨南大学附属第五医院首席专家、影像科主任导师;广东省医学领军人才,广东省医学教育协会会长,广州市分子与功能影像临床转化重点实验室主任,广东省医学影像人工智能精准诊疗工程技术研究中心主任;第十六届中华放射学会委员。广东省“五一劳动奖章”、“广东医师奖”、“南粤优秀教育工作者”、“全国卫生健康系统先进工作者”获得者。先后主持国家自然科学基金、广东省自然科学基金重点项目、粤港澳联合基金项目等20余项科研项目。
