暨医成果要报 I 我校张水兴/张静与何庆瑜团队合作在PNAS发表成果揭示肿瘤免疫逃逸新机制
发布时间:2026-01-05发布单位:医学部/党委医学工作部
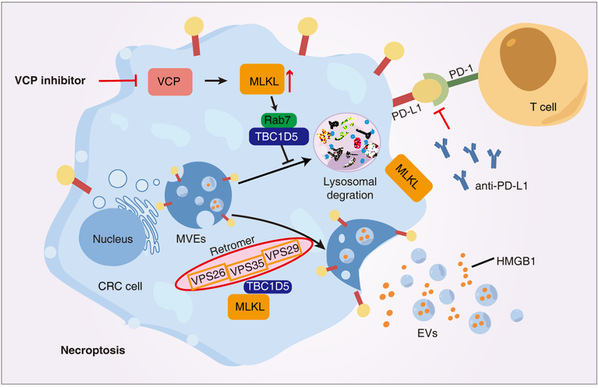
肿瘤细胞常会激活囊泡运输系统构筑自我保护屏障,以逃避死亡信号,这已成为提升疗效的关键障碍。近日,我校附属第一医院张水兴/张静团队联合生命科学技术学院何庆瑜团队,在Proceedings of the National Academy of Sciences of the United States of America (PNAS)杂志上在线发表题为“MLKL/retromer axis controls PD-L1 recycling to compromise antitumor immunity during VCP inhibition–induced necroptosis”的研究论文。该研究发现抑制VCP蛋白可诱导结直肠癌细胞发生程序性坏死,同时伴随激活囊泡运输系统,加速外泌体释放并通过逆向转运复合体介导PD-L1向细胞膜定位,从而影响免疫治疗。

程序性坏死诱导剂具有通过触发肿瘤坏死、释放损伤相关分子模式(DAMPs)来募集抗肿瘤免疫细胞的潜力,可望增强免疫治疗效果。本研究发现,VCP抑制剂能在结直肠癌中引发强烈的程序性坏死,并伴随活性氧爆发和高迁移率族蛋白B1(HMGB1)释放——这些均为明确的免疫原性细胞死亡特征。然而,尽管VCP抑制剂本身具有杀瘤效应,其在体内与抗PD-L1抗体联用时疗效仍受限,原因在于该处理同时诱发了外泌体分泌和PD-L1向细胞表面的转运。
通过基于数据非依赖采集模式的定量蛋白质组学分析,研究团队鉴定出MLKL是VCP的关键底物,VCP抑制可延缓MLKL的蛋白酶体降解。累积的MLKL进一步募集GTP酶激活蛋白TBC1D5,使Rab7A失活,从而将携带PD-L1的囊泡重定向至由逆向转运复合体介导的回收通路,最终递送至细胞膜。这一机制在分子层面解释了VCP抑制剂诱导程序性坏死过程中出现的矛盾性免疫抑制现象。
研究进一步指出,同步靶向逆向转运复合体与VCP,可有效阻断PD-L1的膜回收过程,从而显著增强抗PD-L1疗法的免疫治疗效果。该发现为结直肠癌的联合免疫治疗提供了新的策略思路与潜在靶点。
本研究得到了国家重点研发计划、国家自然科学基金面上项目等项目的支持。
原文链接:https://doi.org/10.1073/pnas.2518675122
