火热八月,硕果累累;一鼓作气,再创佳绩——何蓉蓉教授团队接连发表三篇高分文章,深度揭示磷脂过氧化增加疾病易感性机制
发布时间:2022-08-29发布单位:学科建设与规划办公室
2022年8月,暨南大学中医学院何蓉蓉教授团队在一个月期间连续发表3篇高水平论文,相关研究成果分别发表在国际权威期刊Redox Biol(IF = 10.787)、Signal Transduction and Targeted Therapy(IF=38.104),Redox Biol(IF = 10.787),其中STTT发表论文更是入选杂志封面故事。
研究论文简介:
1. Redox Biol(IF = 10.787)| 磷脂氧化阻碍自噬膜形成!
8月5日,团队在氧化应激领域顶刊Redox Biology(中科院JCR期刊1区,2021年影响因子IF = 10.787)发表了题目为“Phospholipid peroxidation inhibits autophagy via stimulating the delipidation of oxidized LC3-PE”的研究论文。暨南大学广东省疾病易感性及中医药研发工程技术研究中心为第一单位,博士毕业生李文博士为第一作者。暨南大学何蓉蓉教授和孙万阳教授为主通讯作者,合作者中山大学李民教授为共同通讯作者。
磷脂过氧化产物在细胞生命活动过程中发挥重要的信号传导作用,如磷脂过氧化产物的大量堆积是新型细胞死亡方式-铁死亡的主要特征。细胞处于应激状态或发生死亡过程中,往往会伴随着自噬信号通路的激活,形成以双层磷脂膜为特征的自噬体。研究发现,细胞发生铁死亡或在磷脂过氧化物堆积的情况下,自噬形成障碍,但其具体机制未明。该研究采用亚细胞分级分离技术和脂质组学/氧化磷脂组学分析等方法,揭示内质网中磷脂氧化与自噬体形成之间的潜在联系,进一步阐明磷脂过氧化抑制自噬的具体分子机制。研究结果表明,细胞的脂质过氧化导致自噬形成的关键因子LC3-PE发生氧化,氧化型LC3(LC3-PE-OOH)与ATG4B的亲和力增强,导致LC3-PE-OOH的去脂化从而抑制自噬。内质网作为自噬体膜的主要来源之一,其氧化磷脂组成的改变可能抑制自噬体的形成。该研究阐释磷脂过氧化抑制自噬的生物学基础,为相关疾病的病理机制解析和治疗提供科学依据。
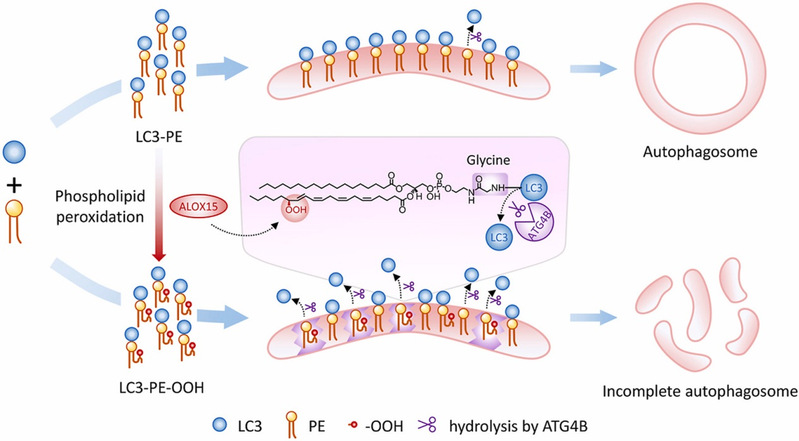
Cite this Article: Li W, Luo LX, Zhou QQ. et al. Phospholipid peroxidation inhibits autophagy via stimulating the delipidation ofoxidized LC3-PE. Redox Biol. 2022 Aug 5; 55: 102421. doi: 10. 1016/j. redox. 2022. 102421.
2、STTT(IF = 38.104)| 提出心肌缺血再灌注损伤发病机制的新论点,丰富中医理论“痰瘀互结”科学内涵!
8月15日,在Nature旗下国际权威期刊Signal Transduction and Targeted Therapy(中科院JCR期刊1区,2021年影响因子IF = 38.104)发表了题目为“ALOX15-launched PUFA-phospholipids peroxidation increases the susceptibility of ferroptosis in ischemia-induced myocardial damage”的研究论文。暨南大学广东省疾病易感性及中医药研发工程技术研究中心为第一通讯单位,暨南大学中西医结合流动站博士后马晓慧博士为第一作者,暨南大学何蓉蓉教授和李怡芳教授为主通讯作者,合作者北京中医药大学商洪才研究员和广州中医药大学陈扬研究员为共同通讯作者。
心肌缺血/再灌注(I/R)损伤是一种典型的心血管疾病,其特征是心肌缺氧损伤导致各种形式的细胞死亡。以往研究认为I/R造成心肌损伤的“罪魁祸首”氧化应激发生在“灌注”期。该研究采用氧化磷脂组学等关键技术,揭示了在“缺血“阶段,磷脂特异性氧化酶ALOX15大量表达,丰富的氧化磷脂为“灌注”阶段强烈的氧化损伤的爆发提供了启动信号(Priming signal),决定了灌注期的氧化损伤程度。此外,该研究基于中医基础理论,利用高脂饮食附加心肌缺血建立“痰瘀互结型”冠心病的研究模型,在对此模型的研究中发现高脂饮食中的不饱和脂肪酸会改变心肌细胞磷脂的构成,为磷脂氧化(“痰”)提供丰富底物,缺血(“瘀”)期诱导磷脂氧化关键酶ALOX15充当“燃烧点”,二者结合加重缺血-灌注损伤。该研究以ALOX15为靶点,从中医临床治疗“痰瘀互结型”冠心病的中药中筛选出活性成分daidzein。该研究为I/R的发病机制提供了新的见解,解析了“痰瘀互结”诱导冠心病的部分科学内涵,为中医药早期干预I/R提供了依据。
入选封面故事
Cite this Article: Ma, XH, Liu, JHZ, Liu, CY. et al. ALOX15-launched PUFA-phospholipids peroxidation increases the susceptibility of ferroptosis in ischemia-induced myocardial damage. Sig Transduct Target Ther. 2022 Aug 15; 7(1): 288. doi: 10.1038/s41392-022-01090-z.
3、Redox Biol(IF = 10.787)| 揭示孕期压力影响胚胎骨发育的新机制!
8月20日,该团队在氧化应激领域顶刊Redox Biology(中科院JCR期刊1区,2021年影响因子IF = 10.787)发表了题目为“Phospholipid peroxidation-driven modification of chondrogenic transcription factor mediates alkoxyl radicals-induced impairment of embryonic bone development”的研究论文。暨南大学广东省疾病易感性及中医药研发工程技术研究中心为第一通讯单位,暨南大学药学院博士研究生牛杰为第一作者,硕士万欣、余桂媛、姜珊为共同第一作者,暨南大学何蓉蓉教授和李怡芳教授为主通讯作者,团队成员段文君研究员和博士后何剑波博士为共同通讯作者。
妊娠期间身体变化、工作压力、生活压力带来的各种情志应激,以及环境污染等外来刺激,都能导致母体子宫内形成大量的自由基,影响胎儿的器官发育。越来越多的临床流行病学调查研究表明,产前母体由于长期处于应激状态下,产生的自由基能够导致胎儿早产、胎儿体重偏低和身材矮小等负面影响。然而关于母体应激产生的氧化损伤导致胚胎骨发育障碍的相关机制尚不清楚。该研究以氧化磷脂组学等技术为基础,确定了铁依赖性的磷脂过氧化在烷氧基自由基引起的软骨发育缺陷中的关键作用。研究进一步发现烷氧基自由基抑制骨发育的作用机理为脂质过氧化终产物4-羟基壬烯醛(HNE)与关键的软骨生成转录因子SOX9形成加合物,导致SOX9泛素化降解,进而抑制了胚胎软骨的正常发育,最终造成整个骨骼的发育障碍。该研究阐明了烷氧基自由基诱导的磷脂过氧化是软骨发育障碍的重要病理机制,为临床改善母体应激导致的子代骨发育异常提供重要参考。
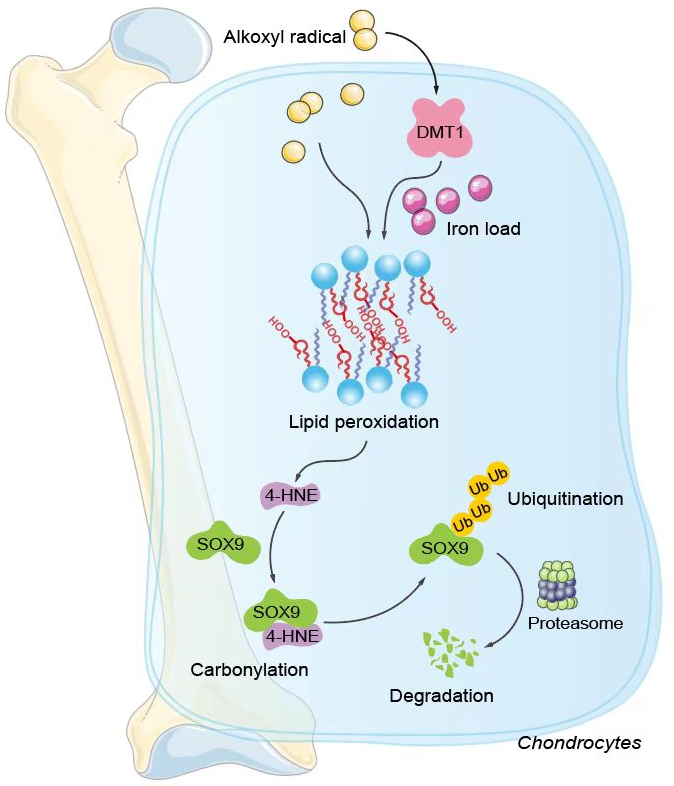
Cite this Article: Niu J, Wan X, Yu GY, Jiang S, et al. Phospholipid peroxidation-driven modification of chondrogenic transcription factor mediates alkoxyl radicals-induced impairment of embryonic bone development. Redox Biology. 2022 Aug 20; 56: 102437. doi. org/10. 1016/j. redox. 2022. 102437.
厉兵秣马秉初心,蓄势待发再启程。何蓉蓉教授团队在多项国家自然科学基金的持续资助下,从“情志应激”增加疾病“易感性”出发,开展对情志致病理论的生物医学基础系列研究。团队分别建立多种符合中医药作用特点模型,从帕金森病、乳腺癌、渐冻人症不同疾病角度,探索情志应激的引起效应细胞不饱和磷脂的过氧化作用,解析磷脂过氧化增加重大疾病易感性的重要机制。相关研究成果在2021年已发表在Nat Chem Bio 2021(IF=15.04)、Cell Death Differ 2021 (IF=15.828)等高水平杂志发表,并入选了2021年度中国中医药十大进展。2022年上半年,在Acta Pharm Sin B(IF=14.903)、J Adv Res 2022(IF=12.822)等杂志发表。本次接连的佳绩,不仅是何蓉蓉教授团队前期研究成果的创新延续,更是团队不懈努力,坚定科研求真理想信念的重要体现。未来,将继续以“守正创新”为核心理念,深入挖掘中医情志致病的深刻内涵,以科研力量为传播中医药文化持续贡献自己的一份力量。
团队介绍

暨南大学广东省疾病易感性及中医药研发工程技术研究中心由中华人民共和国国际合作奖获得者日籍栗原博(Kurihara Hiroshi)教授始建于2003年,目前何蓉蓉教授为主要学术带头人,李怡芳、段文君、孙万阳、梁磊、吴燕萍、欧阳淑桦等为研究骨干。该团队主要从事中医情志致病的生物医学基础研究,以“疾病易感性”为理论研究的切入点,重点研究情志应激引起神经-内分泌-免疫网络的氧化应激损伤的病理机制,致力于创新性建立“疾病易感性”的中医药评价体系。目前,聚焦在氧化应激机制,尤其是脂质氧化方面研究,与美国匹兹堡大学Kagan教授团队合作已建立了完善氧化脂质组学检测平台。
